¿Qué es la
destilación?
La destilación es un
proceso de separación física que se basa en las diferencias en los puntos de
ebullición de los componentes de una mezcla líquida. Este método permite
separar sustancias al calentar la mezcla hasta que uno o más componentes se
vaporicen, para luego condensarlos en un estado líquido en otro recipiente. La
destilación es ampliamente utilizada en la industria química, petroquímica,
alimentaria y farmacéutica debido a su eficiencia en la purificación y
separación de sustancias.
El principio básico
de la destilación radica en el hecho de que cada componente de una mezcla tiene
un punto de ebullición único. Cuando se aplica calor a la mezcla, el componente
con el punto de ebullición más bajo se vaporiza primero, dejando atrás los
componentes con puntos de ebullición más altos. El vapor formado se dirige a un
condensador, donde se enfría y regresa a su estado líquido, siendo recolectado
como un destilado. Este proceso puede repetirse para obtener una mayor pureza
en los componentes separados.
Existen varios tipos
de destilación, como la destilación simple, la destilación fraccionada, la
destilación al vacío y la destilación azeotrópica, cada una diseñada para
necesidades específicas. Por ejemplo, la destilación fraccionada se utiliza
cuando los puntos de ebullición de los componentes son cercanos, mientras que
la destilación al vacío es ideal para sustancias sensibles al calor que podrían
descomponerse a altas temperaturas.
La destilación tiene
aplicaciones fundamentales en diversos sectores. En la industria petroquímica,
es clave para separar hidrocarburos como gasolina, queroseno y diésel a partir
del petróleo crudo. En la industria alimentaria, se utiliza para producir
bebidas alcohólicas mediante la separación del etanol de una mezcla fermentada.
Además, en laboratorios químicos y farmacéuticos, se emplea para purificar
compuestos y obtener sustancias químicas de alta pureza.
¿Para qué sirve la
destilación?
La destilación es
fundamental para la separación, purificación y recuperación de componentes en
mezclas líquidas, gracias a su capacidad de separar sustancias basándose en sus
diferentes puntos de ebullición. En la industria petroquímica, la destilación
sirve para descomponer el petróleo crudo en fracciones como gasolina, diésel, y
queroseno, esenciales para la producción de combustibles y productos derivados.
En el sector alimentario, este proceso permite la obtención de bebidas
alcohólicas mediante la separación del etanol de mezclas fermentadas,
contribuyendo a la calidad y sabor de estos productos.
En laboratorios y la
industria farmacéutica, la destilación se emplea para purificar productos
químicos, remover impurezas o concentrar soluciones, asegurando que cumplan con
estándares de calidad y seguridad. Además, en el tratamiento de agua, este
método es utilizado para desalinizar agua de mar y obtener agua potable.
Tipos de destilación
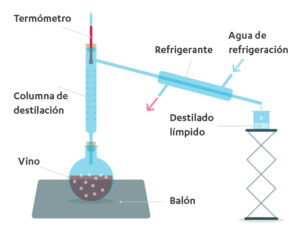
Destilación simple: La destilación simple es el método más
básico y se utiliza cuando los puntos de ebullición de los componentes de la
mezcla tienen una diferencia significativa (generalmente mayor a 25 °C). En
este proceso, la mezcla se calienta hasta que el componente con el punto de
ebullición más bajo se vaporiza. Este vapor se conduce a un condensador donde
se enfría y se convierte en líquido, que luego se recoge como destilado. La
destilación simple es ideal para separar mezclas de líquidos y sólidos
disueltos, como agua y sales, o para purificar líquidos volátiles.
Aunque es un método
sencillo, tiene limitaciones, ya que no es eficiente para separar componentes
con puntos de ebullición cercanos. Además, no permite obtener un alto grado de
pureza en el componente separado, ya que pueden quedar rastros del otro
componente en el destilado. Por esta razón, la destilación simple se emplea
principalmente en aplicaciones básicas como la obtención de agua destilada o la
separación inicial de mezclas complejas.
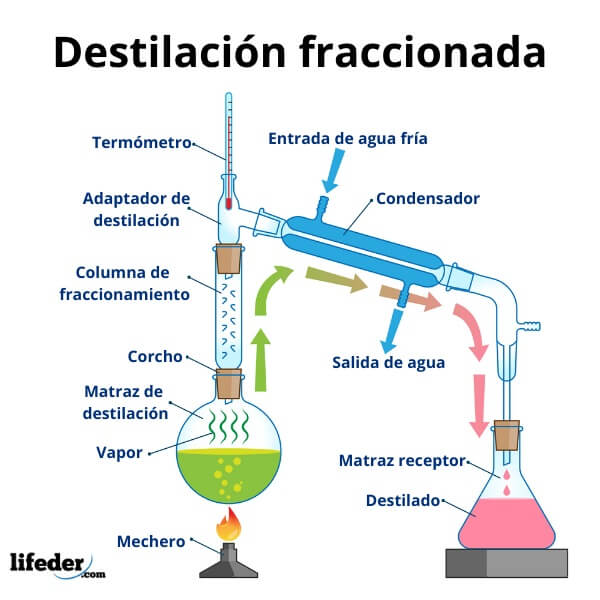
Destilación fraccionada: La destilación fraccionada se utiliza
para separar componentes con puntos de ebullición cercanos. Este proceso emplea
una columna de fraccionamiento, que contiene bandejas o empaques que aumentan
el área de contacto entre el vapor y el líquido. A medida que el vapor asciende
por la columna, se enfría gradualmente, permitiendo que los componentes con
puntos de ebullición más altos se condensen y regresen al fondo de la columna,
mientras que los componentes más volátiles ascienden y son recolectados como
destilado.
Este tipo de
destilación es ampliamente utilizado en la industria petroquímica, donde es
crucial para descomponer el petróleo crudo en diferentes fracciones como
gasolina, queroseno y diésel. También se emplea en la producción de bebidas
alcohólicas y en la separación de gases industriales. Su eficiencia radica en
la capacidad de realizar múltiples etapas de separación en un solo proceso,
logrando productos de mayor pureza.
Destilación al vacío: La destilación al vacío se lleva a cabo
a presiones reducidas, lo que permite que los componentes se vaporicen a
temperaturas más bajas de las que alcanzarían a presión atmosférica. Este
método es ideal para sustancias sensibles al calor que podrían descomponerse o
reaccionar a altas temperaturas, como aceites esenciales o productos químicos
delicados.
Al reducir la
temperatura necesaria para la ebullición, este tipo de destilación protege la
calidad de los compuestos separados y reduce el consumo de energía en
comparación con los procesos convencionales. Es ampliamente utilizada en la
industria farmacéutica, en la producción de aceites esenciales y en la
separación de compuestos complejos en laboratorios de investigación.
Destilación azeotrópica: La destilación azeotrópica se emplea
para separar mezclas que forman azeótropos, es decir, combinaciones de líquidos
que hierven a una composición constante y no pueden separarse completamente
mediante destilación simple o fraccionada. Para superar este límite, se agrega
un tercer componente (un agente entrante) que altera las propiedades del
azeótropo y permite su separación.
Este método es común
en la industria química para deshidratar soluciones o purificar compuestos que
no pueden ser separados de otra manera, como el etanol al 96% que forma un azeótropo
con el agua. Aunque es un proceso más complejo y costoso, su utilidad radica en
la capacidad de superar las limitaciones de los métodos de destilación
tradicionales.
Bibliografía
Ardila, J., &
López, A. (2017). Procesos de separación: Principios y
aplicaciones
industriales.
Bogotá: Editorial Científica.
Felder, R. M., &
Rousseau, R. W. (2016). Principios elementales de los procesos
químicos.
México: Editorial Limusa.
Geankoplis, C. J.
(2016). Procesos de transporte y separación en ingeniería química
(4ª
ed.). Madrid: McGraw-Hill.
Medina, P. A. (2019).
Técnicas avanzadas de destilación en la industria química.
Santiago: Editorial Industrial.
Seader,
J. D., Henley, E. J., & Roper, D. K. (2016). Separation Process Principles.
Nueva York: Wiley.




No hay comentarios.:
Publicar un comentario